Struktur atom
Struktur atom merupakan satuan dasar materi yang terdiri dari inti atom beserta awan elektron bermuatan negatif yang mengelilinginya.[1] Inti atom mengandung campuran proton yang bermuatan positif dan neutron yang bermuatan netral (terkecuali pada Hidrogen-1 yang tidak memiliki neutron). Elektron-elektron pada sebuah atom terikat pada inti atom oleh gaya elektromagnetik. Demikian pula sekumpulan atom dapat berikatan satu sama lainnya membentuk sebuah molekul. Atom yang mengandung jumlah proton dan elektron yang sama bersifat netral, sedangkan yang mengandung jumlah proton dan elektron yang berbeda bersifat positif atau negatif dan merupakan ion. Atom dikelompokkan berdasarkan jumlah proton dan neutron pada inti atom tersebut. Jumlah proton pada atom menentukan unsur kimia atom tersebut, dan jumlah neutron menentukan isotop unsur tersebut.
Istilah atom berasal dari Bahasa Yunani, yang berarti tidak dapat dipotong ataupun sesuatu yang tidak dapat dibagi-bagi lagi. Konsep atom sebagai komponen yang tak dapat dibagi-bagi lagi pertama kali diajukan oleh para filsuf India dan Yunani. Pada abad ke-17 dan ke-18, para kimiawan meletakkan dasar-dasar pemikiran ini dengan menunjukkan bahwa zat-zat tertentu tidak dapat dibagi-bagi lebih jauh lagi menggunakan metode-metode kimia. Selama akhir abad ke-19 dan awal abad ke-20, para fisikawan berhasil menemukan struktur dan komponen-komponen subatom di dalam atom, membuktikan bahwa 'atom' tidaklah tak dapat dibagi-bagi lagi.[2] Prinsip-prinsip mekanika kuantum yang digunakan para fisikawan kemudian berhasil memodelkan atom. [3]
Relatif terhadap pengamatan sehari-hari, atom merupakan objek yang sangat kecil dengan massa yang sama kecilnya pula. Atom hanya dapat dipantau menggunakan peralatan khusus seperti mikroskop penerowongan payaran. Lebih dari 99,9% massa atom berpusat pada inti atom, dengan proton dan neutron yang bermassa hampir sama. Setiap unsur paling tidak memiliki satu isotop dengan inti yang tidak stabil yang dapat mengalami peluruhan radioaktif. Hal ini dapat mengakibatkan transmutasi yang mengubah jumlah proton dan neutron pada inti. Elektron yang terikat pada atom mengandung sejumlah aras energi, ataupun orbital, yang stabil dan dapat mengalami transisi di antara aras tersebut dengan menyerap ataupun memancarkan foton yang sesuai dengan perbedaan energi antara aras. Elektron pada atom menentukan sifat-sifat kimiawi sebuah unsur dan mempengaruhi sifat-sifat magnetis atom tersebut. [4]
Macam-macam Model Atom
[sunting]1. Model Atom John Dalton
Pada tahun 1808, John Dalton adalah seorang guru di Inggris yang melakukan perenungan tentang atom. Hasil perenungan Dalton menyempurnakan teori atom Democritus. Bayangan Dalton dan Democritus adalah bahwa benda itu berbentuk pejal. [7]. Dalam perenungannya Dalton mengemukakan postulatnya tentang atom.
a. Setiap unsur terdiri dari partikel yang sangat keci yang dinamakan dengan atom
b. Atom dari unsur yang sama memiliiki sifat yang sama
c. Atom dari unsur berbeda memiliki sifat yang berbeda pula
d. Atom dari suatu unsur tidak dapat diubah menjadi atom unsur lain dengan reaksi kimia, atom tidak dapat dimusnahkan dan atom juga tidak dapat dihancurkan
e. Atom-atom dapat bergabung membentuk gabungan atom yang disebut molekul
f. Dalam senyawa, perbandingan massa masing-masing unsur adalah tetap
Kelebihan model atom Dalton:
Mulai membangkitkan minat terhadap penelitian mengenai model atom.
Kelemahan model atom John Dalton :
Teori atom Dalton tidak dapat menerangkan suatu larutan dapat menghantarkan arus listrik. Bagaimana mungkin bola pejal dapat menghantarkan arus listrik? padahal listrik adalah elektron yang bergerak. Berarti ada partikel lain yang dapat menghantarkan arus listrik. [8]
[sunting]2. Model Atom J.J. Thomson
Pada tahun 1897, J.J Thomson mengamati elektron.[9] Dia menemukan bahwa semua atom berisi elektron yang bermuatan negatif.[10] Dikarenakan atom bermuatan netral, maka setiap atom harus berisikan partikel bermuatan positif agar dapat menyeimbangkan muatan negatif dari elektron.[11]
Kelebihan model atom Thomson
Membuktikan adanya partikel lain yang bermuatan negatif dalam atom. Berarti atom bukan merupakan bagian terkecil dari suatu unsur.
Kelemahan model atom Thomson
Model Thomson ini tidak dapat menjelaskan susunan muatan positif dan negatif dalam bola atom tersebut.
[sunting]3. Model Atom Rutherford
Rutherford melakukan penelitian tentang hamburan sinar α pada lempeng emas. Hasil pengamatan tersebut dikembangkan dalam hipotesis model atom Rutherford.
a. Sebagian besar dari atom merupakan permukaan kosong.
b. Atom memiliki inti atom bermuatan positif yang merupakan pusat massa atom.
c. Elektron bergerak mengelilingi inti dengan kecepatan yanga sangat tinggi.
d. Sebagian besar partikel α lewat tanpa mengalami pembelokkan/hambatan. Sebagian kecil dibelokkan, dan sedikit sekali yang dipantulkan.
a. Menurut hukum fisika klasik, elektron yang bergerak mengelilingi inti memancarkan energi dalam bentuk gelombang elektromagnetik. Akibatnya, lama-kelamaan elektron itu akan kehabisan energi dan akhirnya menempel pada inti.
b. Model atom rutherford ini belum mampu menjelaskan dimana letak elektron dan cara rotasinya terhadap ini atom.
c. Elektron memancarkan energi ketika bergerak, sehingga energi atom menjadi tidak stabil.
d. Tidak dapat menjelaskan spektrum garis pada atom hidrogen (H).
[sunting]4. Model Atom Niels Bohr
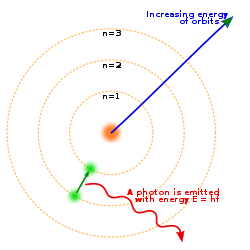
Pada tahun 1913, Niels Bohr mengemukakan pendapatnya bahwa elektron bergerak mengelilingi inti atom pada lintasan-lintasan tertentu yang disebut kulit atom. [12] Model atom Bohr merupakan penyempurnaan dari model atom Rutherford.
Kelemahan teori atom Rutherford diperbaiki oleh Neils Bohr dengan postulat bohr :
a. Elektron-elektron yang mengelilingi inti mempunyai lintasan dan energi tertentu.
b. Dalam orbital tertentu, energi elektron adalah tetap. Elektron akan menyerap energi jika berpindah ke orbit yang lebih luar dan akan membebaskan energi jika berpindah ke orbit yang lebih dalam
Kelebihan model atom Bohr
atom terdiri dari beberapa kulit untuk tempat berpindahnya elektron.
Kelemahan model atom Bohr
a. tidak dapat menjelaskan efek Zeeman dan efek Strack.
b. Tidak dapat menerangkan kejadian-kejadian dalam ikatan kimia dengan baik, pengaruh medan magnet terhadap atom-atom, dan spektrum atom yang berelektron lebih banyak.
Sistem periodik Unsur
Tabel periodik unsur-unsur kimia adalah tampilan unsur-unsur kimia dalam bentuk tabel. Unsur-unsur tersebut diatur berdasarkan struktur elektronnya sehingga sifat kimia unsur-unsur tersebut berubah-ubah secara teratur sepanjang tabel. Setiap unsur didaftarkan berdasarkan nomor atom dan lambang unsurnya.
Tabel periodik standar memberikan informasi dasar mengenai suatu unsur. Ada juga cara lain untuk menampilkan unsur-unsur kimia dengan memuat keterangan lebih atau dari persepektif yang berbeda.
Penjelasan struktur tabel periodik
Jumlah kulit elektron yang dimiliki sebuah atom menentukan periode atom tersebut. Setiap kulit memiliki beberapa subkulit, yang terisi menurut urutan berikut ini, seiring dengan bertambahnya nomor atom:
1s
2s 2p
3s 3p
4s 3d 4p
5s 4d 5p
6s 4f 5d 6p
7s 5f 6d 7p
8s 5g 6f 7d 8p
...
Berdasarkan hal inilah struktur tabel disusun. Karena elektron terluar menentukan sifat kimia suatu unsur, unsur-unsur yang segolongan umumnya mempunyai sifat kimia yang mirip. Unsur-unsur segolongan yang berdekatan mempunyai sifat fisika yang mirip, meskipun massa mereka jauh berbeda. Unsur-unsur seperiode yang berdekatan mempunyai massa yang hampir sama, tetapi sifat yang berbeda.
Sebagai contoh, dalam periode kedua, yang berdekatan dengan Nitrogen (N) adalah Karbon (C) dan Oksigen (O). Meskipun massa unsur-unsur tersebut hampir sama (massanya hanya selisih beberapa satuan massa atom), mereka mempunyai sifat yang jauh berbeda, sebagaimana bisa dilihat dengan melihat alotrop mereka: oksigen diatomik adalah gas yang dapat terbakar, nitrogen diatomik adalah gas yang tak dapat terbakar, dan karbon adalah zat padat yang dapat terbakar (ya, berlian pun dapat terbakar!).
Sebaliknya, yang berdekatan dengan unsur Klorin (Cl) di tabel periodik, dalam golongan Halogen, adalah Fluorin (F) dan Bromin (Br). Meskipun massa unsur-unsur tersebut jauh berbeda, alotropnya mempunyai sifat yang sangat mirip: Semuanya bersifat sangat korosif (yakni mudah bercampur dengan logam membentuk garam logam halida); klorin dan fluorin adalah gas, sementara bromin adalah cairan bertitik didih yang rendah; sedikitnya, klorin dan bromin sangat berwarna.
[sunting]Klasifikasi
[sunting]Golongan
Kolom dalam tabel periodik disebut golongan. Ada 18 golongan dalam tabel periodik baku. Unsur-unsur yang segolongan mempunyai konfigurasi elektron valensi yang mirip, sehingga mempunyai sifat yang mirip pula. Ada tiga sistem pemberian nomor golongan. Sistem pertama memakai angka Arab dan dua sistem lainnya memakai angka Romawi. Nama dengan angka Romawi adalah nama golongan yang asli tradisional. Nama dengan angka Arab adalah sistem tatanama baru yang disarankan oleh International Union of Pure and Applied Chemistry (IUPAC). Sistem penamaan tersebut dikembangkan untuk menggantikan kedua sistem lama yang menggunakan angka Romawi karena kedua sistem tersebut membingungkan, menggunakan satu nama untuk beberapa hal yang berbeda.
Golongan bisa dianggap sebagai cara yang paling penting dari mengklasifikasi unsur. Pada beberapa golongan, unsur-unsurnya ada yang sangat mirip sifatnya dan memiliki kecenderungan sifat yang jelas jika ditelusuri menurun di dalam kolom. Golongan-golongan ini sering diberi nama umum (tak sistematis) sebagai contoh: logam alkali, logam alkali tanah,halogen, khalkogen, dan gas mulia. Beberapa golongan lainnya dalam tabel tidak menampilkan sebanyak persamaan maupun kecenderungan sifat secara vertikal (sebagai contoh Kelompok 14 dan 15), golongan ini tidak memiliki nama umum.
[sunting]Periode
Baris dalam tabel periodik disebut periode. Walaupun golongan adalah cara yang paling umum untuk mengklasifikasi unsur, ada beberapa bagian di tabel unsur yang kecenderungan sifatnya secara horisontal dan kesamaan sifatnya lebih penting dan mencolok daripada kecenderungan vertikal. Fenomena ini terjadi di blok-d (atau "logam transisi"), dan terutama blok-f, dimana lantinida dan aktinida menunjukan sifat berurutan yang sangat mencolok.
[sunting]Periodisitas Sifat Kimia
Nilai utama dari tabel periodik adalah kemampuan untuk memprediksi sifat kimia dari sebuah unsur berdasarkan lokasi di tabel. Perlu dicatat bahwa sifat kimia berubah banyak jika bergerak secara vertikal di sepanjang kolom di dalam tabel dibandingkan secara horizontal sepanjang baris.
[sunting]Kecenderungan Periodisitas dalam Golongan
Teori struktur atom mekanika kuantum modern menjelaskan kecenderungan golongan dengan memproposisikan bahwa unsur dalam golongan yang sama memiliki konfigurasi elektron yang sama dalam kulit terluarnya, yang merupakan faktor terpenting penyebab sifat kimia yang mirip. Unsur-unsur dalam golongan yang sama juga menunjukkan pola jari-jari atom, energi ionisasi, dan elektronegativitas. Dari urutan atas ke bawah dalam golongan, jari-jari atom unsur bertambah besar. Karena lebih banyak susunan energi yang terisi, elektron valensi terletak lebih jauh dari inti. Dari urutan atas, setiap unsur memiliki energi ionisasi yang lebih rendah dari unsur sebelumnya karena lebih mudahnya sebuah elektron terlepas karena elektron terluarnya yang semakin jauh dari inti. Demikian pula, suatu golongan juga menampilkan penurunan elektronegativitas dari urutan atas ke bawah karena peningkatan jarak antara elektron valensi dan inti.
[sunting]Kecenderungan Periodisasi Periode
Unsur-unsur dalam periode yang sama memiliki kecenderungan dalam jari-jari atom, energi ionisasi, afinitas elektron dan elektronegativitas. Dari kiri ke kanan, jari-jari atom biasanya menurun. Hal ini terjadi karena setiap unsur mendapat tambahan proton dan elektron yang menyebabkan elektron tertarik lebih dekat ke inti. Penurunan jari-jari atom ini juga menyebabkan meningkatnya energi ionisasi jika bergerak dari urutan kiri ke kanan. Semakin rapat terikatnya suatu unsur, semakin banyak energi yang diperlukan untuk melepaskan sebuah elektron. Demikian juga elektronegativitas, yang meningkat bersamaan dengan energi ionisasi karena tarikan oleh inti pada elektron. Afinitas elektron juga mempunyai kecenderungan, walau tidak semenyolok pada sebuah periode. Logam (bagian kiri dari perioda) pada umumnya memiliki afinitas elektron yang lebih rendah dibandingkan dengan unsur nonmetal (periode sebelah kanan), dengan pengecualian gas mulia.
[sunting]Sejarah
Artikel utama: Sejarah tabel periodik
Tabel periodik pada mulanya diciptakan tanpa mengetahui struktur dalam atom: jika unsur-unsur diurutkan berdasarkan massa atom lalu dibuat grafik yang menggambarkan hubungan antara beberapa sifat tertentu dan massa atom unsur-unsur tersebut, akan terlihat suatu perulangan atau periodisitas sifat-sifat tadi sebagai fungsi dari massa atom. Orang pertama yang mengenali keteraturan tersebut adalah ahli kimia Jerman, yaitu Johann Wolfgang Döbereiner, yang pada tahun 1829 memperhatikan adanya beberapa triade unsur-unsur yang hampir sama.
| Beberapa triade | ||
|---|---|---|
| Unsur | Massa atom | Kepadatan |
| Klorin | 35,5 | 0,00156 g/cm3 |
| Bromin | 79,9 | 0,00312 g/cm3 |
| Iodin | 126,9 | 0,00495 g/cm3 |
| Kalsium | 40,1 | 1,55 g/cm3 |
| Stronsium | 87,6 | 2,6 g/cm3 |
| Barium | 137 | 3,5 g/cm3 |
Temuan ini kemudian diikuti oleh ahli kimia Inggris, yaitu John Alexander Reina Newlands, yang pada tahun 1865 memperhatikan bahwa unsur-unsur yang bersifat mirip ini berulang dalam interval delapan, yang ia persamakan dengan oktaf musik, meskipun hukum oktaf-nya diejek oleh rekan sejawatnya. Akhirnya, pada tahun 1869, ahli kimia Jerman Lothar Meyerdan ahli kimia Rusia Dmitry Ivanovich Mendeleyev hampir secara bersamaan mengembangkan tabel periodik pertama, mengurutkan unsur-unsur berdasarkan massanya. Akan tetapi, Mendeleyev meletakkan beberapa unsur menyimpang dari aturan urutan massa agar unsur-unsur tersebut cocok dengan sifat-sifat tetangganya dalam tabel, membetulkan kesalahan beberapa nilai massa atom, dan meramalkan keberadaan dan sifat-sifat beberapa unsur baru dalam sel-sel kosong di tabelnya. Keputusan Mendeleyev itu belakangan terbukti benar dengan ditemukannya struktur elektronik unsur-unsur pada akhir abad ke-19 dan awal abad ke-20.







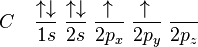
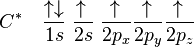
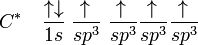




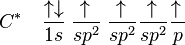
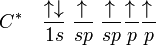



 or
or 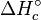
 .
. .
.